Teoría de Dalton
En 1808, John Dalton enunció su célebre teoría atómica, en la que consideró que estos eran esferas indivisibles y elementales constituyentes de la materia., sus postulados:
• La materia está formada por pequeñas partículas, separadas e indivisibles, llamadas
átomos.
• La materia que tiene todos sus átomos iguales es un elemento.
• Los átomos de los diferentes elementos se distinguen por su masa y sus propiedades.


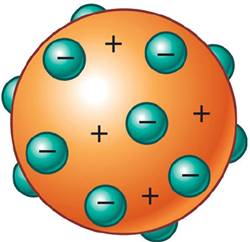
Teoría de Thomson
En 1904, Joseph J. Thomson propuso un modelo muy elemental: el átomo está constituido por
una esfera de materia con carga positiva, en la que se encuentran encajados los electrones
en número suficiente para neutralizar su carga.
La distribución de las cargas propuesta por Thomson explicaba la aparición de los rayos
catódicos y los rayos canales:
• Al desprenderse los electrones de los átomos, forman los rayos catódicos, que se desplazan
hacia el ánodo.
• El resto del átomo, con carga positiva, se dirige hacia el cátodo y forma los rayos canales.
El modelo de Thomson presenta una visión estática y no nuclear
del átomo.
El modelo atómico propuesto por Thomson tuvo una vida muy corta, pero fue de gran importancia, ya que constituye el inicio del estudio profundo del átomo.
El átomo está formado por protones y electrones.

Teoría de Rutherford
En su experiencia, Rutherford dedujo que en el centro del átomo hay un diminuto corpúsculo, al que llamó núcleo, en el que se encuentran las partículas de carga positiva, los protones.
Además, ya intuyó la presencia de neutrones en el núcleo.
El descubrimiento del núcleo condujo a E. Rutherford a establecer un nuevo modelo atómico. Propuso que:
—La mayor parte de la masa y toda carga positiva del átomo se concentran en una minúscula zona central de gran densidad, el núcleo.
—El átomo, mucho mayor que el núcleo, incluye la corteza electrónica, que es la región donde los electrones describen órbitas circulares alrededor del núcleo.
—-El átomo es neutro porque el número de electrones es igual al de protones.

El modelo planetario de Bohr
En 1913, el físico danés Niels Bohr propuso un nuevo modelo atómico. Para Bohr, los electrones giraban en torno al núcleo en órbitas circulares de radios definidos, pero no en todas las órbitas, pues para él existían órbitas permitidas y otras prohibidas.
En cada una de estas órbitas solo puede haber un número dado de electrones, con una energía determinada. Para que un electrón cambie de órbita, es necesario modificar su energía en una cantidad determinada.
El parecido del modelo con los modelos planetarios, y el hecho de que interpretara ciertos sucesos experimentales, que por entonces carecían de explicación, hicieron que tuviera un éxito inmediato.
Hacia 1925, nuevos avances, tanto experimentales como teóricos, obligaron a proponer un nuevo modelo: el modelo atómico de orbitales. A partir de los trabajos de científicos como Max Planck, Louis De Broglie, Werner Heisenberg, Erwin Schrödinger y otros, se ha establecido el modelo atómico actual.
En este modelo, los electrones no describen órbitas definidas en torno al núcleo, como había supuesto Rutherford, sino que se encuentran distribuidos ocupando orbitales.
Este modelo es acertado a nivel atómico y molecular (moléculas, átomos y partículas subatómicas).

Modelo de Sommerfeld
En 1915, el físico alemán A. Sommerfeld (1868-1951) propone las órbitas circulares y elípticas
a partir del segundo nivel de energía donde están los electrones girando alrededor del núcleo.
El electrón se mueve en una órbita circular y también en una órbita elíptica, como observamos
en el gráfico.

BIENVENIDOS
ResponderEliminarhttps://3parcialquim3.wordpress.com/que-es-la-quimica/
ResponderEliminarObserva el video y responde las siguientes interrogantes
1.-Que entiendes por Química ?
2.- Cómo aplicamos la Química en nuestro diario vivir
3.-porqué debemos aprender Química